z6尊龙凯时移植药学前沿文摘丨第9期:来特莫韦和缬更昔洛韦预防高危肾移植受者巨细
Z6尊龙新版官网网页版“移植药师主题(SOTP,Solid Organ Transplantation Pharmacy)月评共同发起的移植药师相关学术月评专栏,每月以移植用药为主题展开,旨在介绍国内外移植药物治疗热点,帮助药师快速了解有关领域的进展,提高移植药学服务水平。我们期望本专栏能为医药领域的专家和研究人员提供深入了解相关热点的平台,并为寻求实用知识的一线移植药师提供有益的参考和指导。
2023年7月,华盛顿大学医学院Ajit P. Limaye教授在The Journal of the American Medical Association(JAMA)发表了一篇关于比较来特莫韦与缬更昔洛韦预防高危肾移植受者巨细胞病毒(cytomegalovirus,CMV)的非劣效性III期临床研究。此项双盲双模拟、随机对照、非劣效性临床研究共纳入94个医疗机构601例接受供体血清CMV阳性的CMV阴性肾移植受者(D+/R-)。参与者在肾移植后随机(1:1)分配接受来特莫韦或缬更昔洛韦治疗200天(约28周),并随访52周。结果显示,移植后52周内,来特莫韦预防CMV感染的疗效不劣于缬更昔洛韦,且白细胞减少或中性粒细胞减少发生风险更低。

对于接受供体血清CMV阳性的CMV阴性肾移植受者(D+/R-),服用200天的缬更昔洛韦是预防CMV感染的标准治疗,但其使用受到骨髓抑制的限制。目的:比较来特莫韦和缬更昔洛韦预防肾移植高危感染受者CMV感染的有效性与安全性。方法:2018年5月至2021年4月期间,来自94个医疗机构的接受CMV血清阳性供体器官的CMV 阴性肾移植受者的双盲双模拟、随机对照、非劣效性临床研究。干预:受试者按1:1比例(以接受淋巴细胞清除免疫抑制诱导药物进行分层)随机分配到来特莫韦组(480mg 每天1次口服,同时使用阿昔洛韦)或缬更昔洛韦组(900mg 每天1次口服,根据肾功能调整剂量),持续到移植术后200天。结局指标:主要结局指标是移植后52周内CMV感染发生率(预先设定非劣效性界值为10%),次要结局指标是28周内CMV感染的发生率和52周内CMV感染的发病时间,探索性结局包括CMV DNA的拷贝数和耐药性,安全性指标是28周内白细胞减少或中性粒细胞减少的发生率。结果:在601例受试者中,589例接受了至少一剂的研究药物(平均年龄:49.6岁,男性422例[71.6%])。肾移植后52周内,来特莫韦(n=289)预防CMV感染的疗效并不劣于缬更昔洛韦(n=297)(10.4% vs 11.8%;分层调整差值-1.4%,95%CI: -6.5% - 3.8%)。移植后28周内,来特莫韦组0患者、缬更昔洛韦组5例患者(1.7%)感染CMV感染。两组间CMV发病时间具有可比性(风险比0.9, 95%CI: 0.56 - 1.47)。移植后28周内,来特莫韦组有2.1%患者检测到量化的CMV DNA血症,而缬更昔洛韦组为8.8%。在评估为疑似CMV感染或CMV DNA血症的患者中,缬更昔洛韦组有12.1%(8/66)出现耐药性相关替代突变,而来特莫韦组没有出现(0/52)。移植后28周内,来特莫韦组白细胞减少或中性粒细胞减少的发生率低于缬更昔洛韦组(26.0% vs 64.0%,调整差值-37.9%,95%CI: -45.1% - -30.0%,p<0.001)。与缬更昔洛韦组相比,来特莫韦组因不良事件(4.1% vs 13.5%)或药物相关不良事件(2.7% vs 8.8%)而停药的患者更少。结论:对于接受CMV血清阳性供体器官移植的CMV阴性肾移植受者,来特莫韦预防CMV感染超过52周的疗效并不劣于缬更昔洛韦,且白细胞减少或中性粒细胞减少发生风险更低,支持来特莫韦用于预防高危实体器官移植患者的CMV感染这一适应症。
CMV感染在肾移植受者中具有较高的发病率和死亡率,尤其是接受CMV血清阳性供者移植肾的患者。血清阴性的肾移植受者接受CMV血清阳性供肾,约占肾移植受者总数的20%。预防肾移植患者CMV感染的一线药物为缬更昔洛韦,标准剂量900mg 一天1次,疗程为移植后10天内启用直至移植后200天。该药物需要根据肾功能调整剂量,并且长时间药物暴露或低于治疗浓度容易导致耐药。同时缬更昔洛韦可引起严重的骨髓抑制,可导致停止/中断CMV预防、免疫减量和/或使用粒细胞集落刺激因子(G-CSF)。2017年FDA批准来特莫韦用于接受异基因造血干细胞移植的CMV血清学阳性受者预防CMV感染。与缬更昔洛韦不同的是,来特莫韦不需要根据肾功能调整剂量,与其他抗病毒药物不发生交叉耐药,且没有骨髓毒性,但目前尚未被批准用于实体器官移植的CMV感染预防。本研究通过评估CMV感染、CMV DNA血症、抗病毒耐药性以及白细胞减少、中性粒细胞减少的发生率来比较缬更昔洛韦和来特莫韦在接受CMV血清阳性供体器官的CMV阴性肾移植受者的预防作用和安全性。
纳入标准:2018年5月至2021年4月,来自16个国家94个医疗机构接受CMV血清阳性供肾的CMV血清阴性肾移植受者(年龄≥18岁)。排除标准:随机分组前6个月内曾接受过造血干细胞或其他实体器官移植、多器官或双肾移植以及有CMV感染史或疑似CMV感染的患者。共筛选693例CMV血清阴性受者,预期从CMV血清阳性供体进行肾移植,其中601例入组,589例接受了至少一次来特莫韦或缬更昔洛韦治疗(安全性分析人群),586例患者完成研究(完整分析集),研究人群筛选流程图如图1。
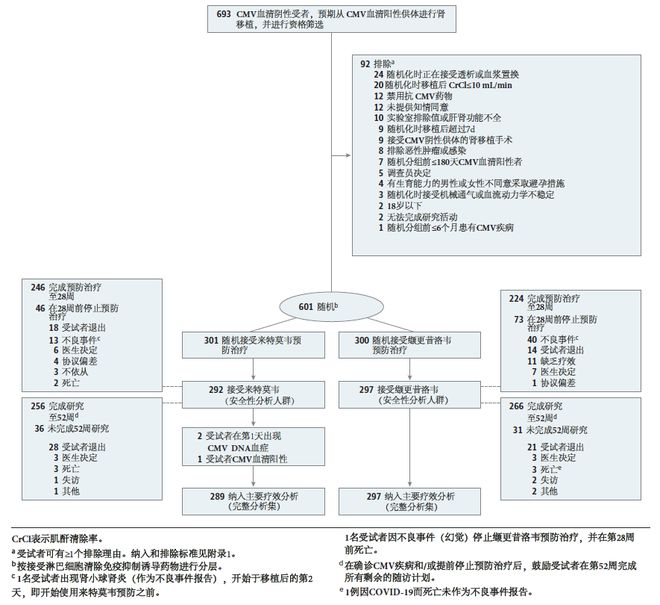
受试者按1:1比例(以接受淋巴细胞清除免疫抑制诱导药物进行分层)随机分配到来特莫韦组(480mg 每天1次口服,同时使用阿昔洛韦)或缬更昔洛韦组(900mg 每天1次口服,根据肾功能调整剂量),同时接受匹配的安慰剂,持续到肾移植术后200天。
主要结局指标:移植后52周内由独立盲法审查委员会证实的CMV感染发生率(预先设定非劣效性界值为10%)。次要结局指标:28周内CMV感染的发生率和52周内CMV感染的发病时间。探索性结局包括移植后28周内和52周内量化的CMV DNA拷贝数以及抗病毒耐药性。安全性结局指标:收集研究期间发生的所有不良事件,同时预先设定的复合安全性结局是预防期间出现以下4个不良事件中的任何1个:白细胞减少症、中性粒细胞减少症、白细胞计数低于3500/μL、中性粒细胞绝对计数低于1000/μL。
假定两组中患CMV感染的线名受试者的样本量将达到90%的有效率,以证明来特莫韦的疗效不劣于缬更昔洛韦,总体双侧α水平为 5%。
主要假设是:移植后52周内,来特莫韦在预防CMV感染方面的疗效不劣于缬更昔洛韦。为满足非劣效性要求,患有CMV感染的受试者百分比差异(来特莫韦减去缬更昔洛韦)的双侧95% CI上限不得高于10%。对于主要分析中的缺失数据,采用观察失败法;因任何原因提前终止研究的受试者不被视为失败者。两组之间的差异及相关的双侧95% CI采用分层调整的Mantel-Haenszel法计算,并根据接受淋巴细胞清除免疫抑制诱导药物的情况进行分层。
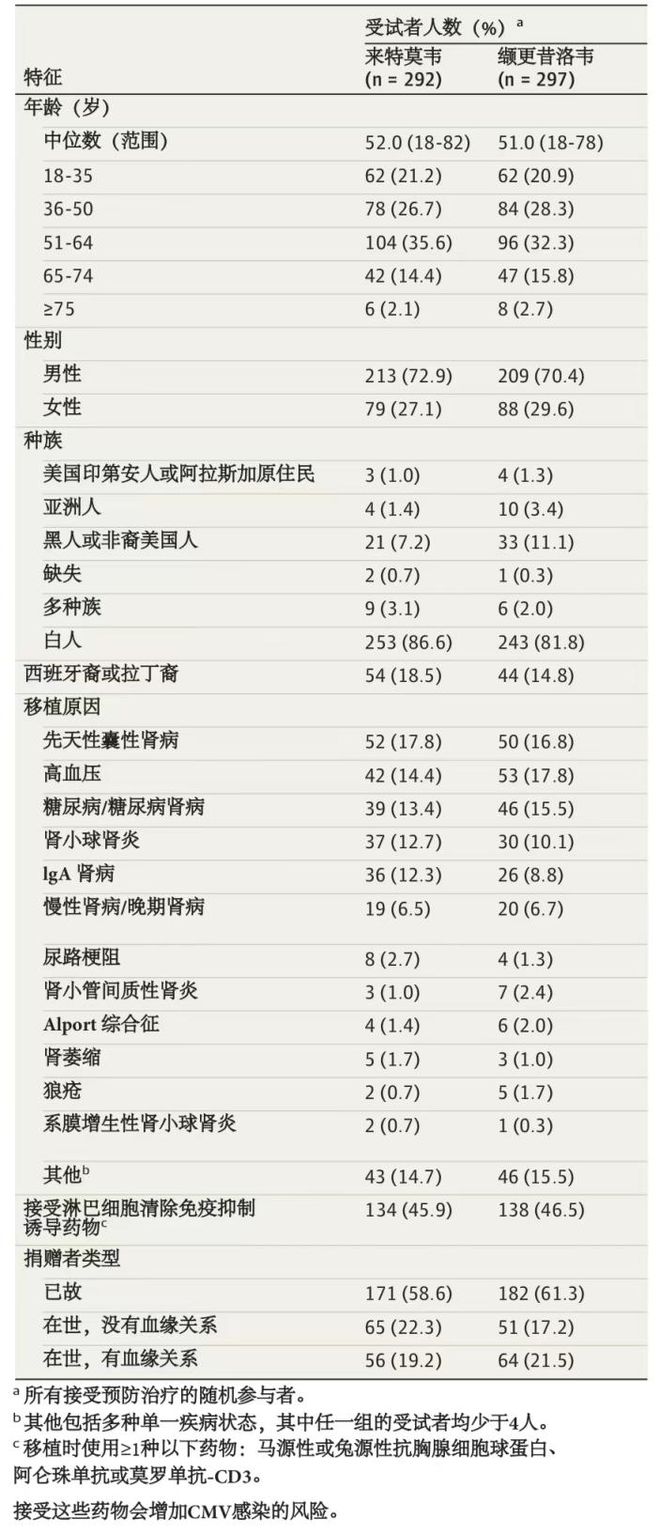
大多数患者为白人(84.2%)和男性(71.6%),半数以上接受了已故捐赠者的肾脏(59.9%)。肾移植最常见的原因包括先天性囊性肾病(17.3%)和高血压(16.1%)。患者口服来特莫韦和缬更昔洛韦的中位时间分别为195(1-237)天和189(1-225)天;其中3名患者接受静脉用来特莫韦,中位时间为1(1-3)天,2名患者接受静脉用更昔洛韦,中位时间为10(1-19)天。预防期间患者最常使用的3种免疫为他克莫司(来特莫韦组97.9%,缬更昔洛韦组97.6%)、霉酚酸类(来特莫韦组95.5%,缬更昔洛韦组96.3%)、糖皮质激素(来特莫韦组95.2%,缬更昔洛韦组92.6%)。
在移植后52周内,来特莫韦组预防CMV感染疗效不劣于缬更昔洛韦组(10.4% vs 11.8%;分层调整差值-1.4%,95%CI:-6.5% - 3.8%)。来特莫韦组和缬更昔洛韦组之间的CMV感染发生率差异在预先设定的亚组中具有可比性,包括接受淋巴细胞清除免疫抑制诱导药物的患者(分层调整差值1.4%,95%CI:-6.7% - 9.6%)。两组间研究者报告的CMV感染发生率差异与主要分析结果一致(分层调整差值0.1%,95%CI:-6.1 % - 6.3%)。
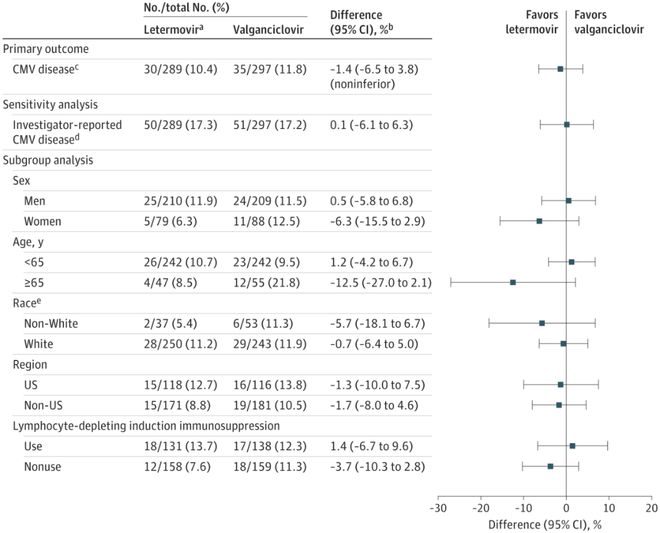
在移植后28周内,来特莫韦组没有患者、缬更昔洛韦组有1.7%患者感染CMV感染(分层调整差值-1.7%,95%CI: -3.4% - 0.1%)。缬更昔洛韦组有3名患者在预防期间出现突破性病毒血症,2名患者在早期停止预防后出现CMV感染。两组患者CMV发病时间具有可比性(风险比0.9,95%CI:0.56 - 1.47)。
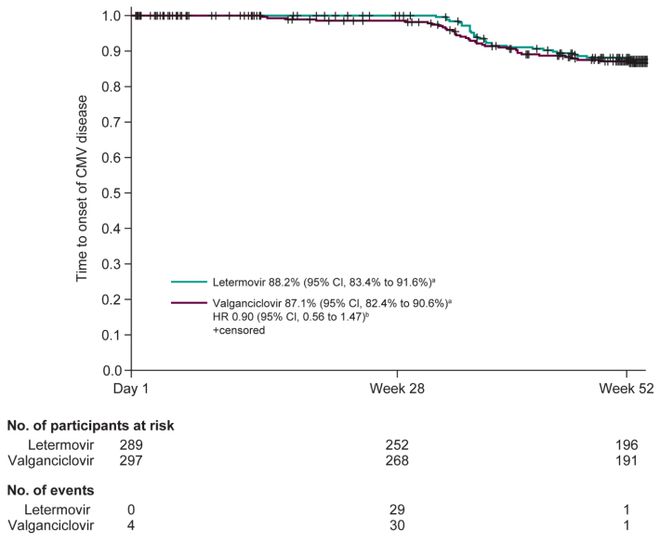
在移植后28周内,来特莫韦组有2.1%患者检测到量化的CMV DNA血症(≥137 IU/mL),缬更昔洛韦组为8.8%;在移植后52周内,来特莫韦组为31.8%,缬更昔洛韦组为37.7%。在评估为疑似CMV感染或CMV DNA血症的患者中,缬更昔洛韦组有12.1%(8/66)出现耐药性相关突变,而来特莫韦组没有出现(0/52)。来特莫韦组两名患者在开始使用缬更昔洛韦治疗CMV感染后出现了与缬更昔洛韦pUL97耐药性相关的替代。
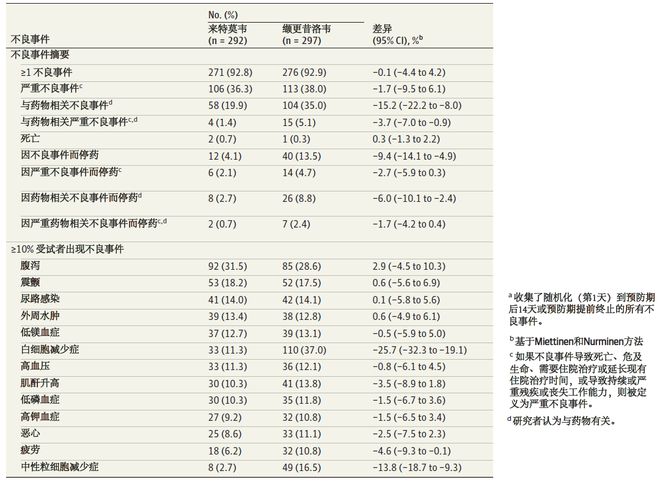
来特莫韦组最常见的不良事件为腹泻、震颤和尿路感染,缬更昔洛韦组为白细胞减少症、腹泻和震颤。偶见心脏事件(如急性心肌梗死、心房颤动、心动过速),两组之间严重不良事件的发生率相似,包括严重的心脏疾病(来特莫韦组 vs 缬更昔洛韦组:2.7% [8/292] vs 3.0% [9/297])。与缬更昔洛韦组相比,来特莫韦组报告的药物相关和严重药物相关不良事件更少。来特莫韦组和缬更昔洛韦组因不良事件而停药的患者分别为4.1%和13.5%(差异-9.4%)。来特莫韦组白细胞减少症和中性粒细胞减少症的发生率低于缬更昔洛韦组(白细胞减少症:11.3% vs 37.0%,中性粒细胞减少症:2.7% vs 16.5%)。其中来特莫韦组导致停药的最常见不良事件为中性粒细胞减少症(1.4%),而缬更昔洛韦组最常见白细胞减少症(5.4%)。
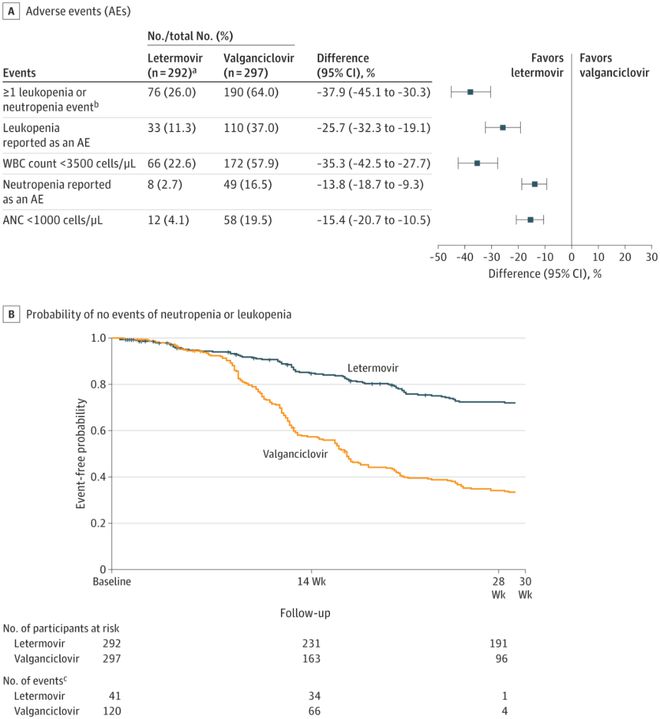
移植后28周内,来特莫韦组白细胞减少或中性粒细胞减少的复合安全性事件发生率低于缬更昔洛韦组(26.0% vs 64.0%,调整差值-37.9%,95%CI: -45.1% - -30.0%,p0.001)。如图4B所示,从第1天到第28周没有发生白细胞减少或中性粒细胞减少的患者。在预防期间,来特莫韦组和缬更昔洛韦组分别有5例(1.7%)和21例(7.1%)患者接受了一次以上的G-CSF治疗。
移植物丢失、移植物排斥和死亡的情况都不常见。移植后52周内,接受来特莫韦治疗和接受缬更昔洛韦治疗分别有2名受者(0.7%)和6名受者(2%)发生移植物丢失。来特莫韦组和缬更昔洛韦组分别有23名(8%)和20名(6.7%)患者经活检证实出现移植物排斥反应。移植后52周内,共报告了6例死亡,其中3例发生在预防期内。研究人员认为这些死亡病例均与药物无关或与CMV感染无关。
本研究存在局限性包括以下5点。首先,大多数参与者为白人男性,但目前尚不清楚性别、种族或民族是否会增加CMV感染的风险。第二,骨髓毒性主要是白细胞减少或中性粒细胞减少,但缬更昔洛韦也可能导致贫血和血小板减少。第三,一些参与者没有完成52周的随访研究,或缺少CMV DNA检测结果,但在所有敏感性分析中,来特莫韦和缬更昔洛韦的CMV患病率相当。第四,没有正式评估与CMV感染相关的长期结果。但由于各组之间的CMV病情相当,因此没有理由预期来特莫韦与缬更昔洛韦的长期疗效会有差异。第五,没有进行成本分析,但成本影响是实施治疗策略的重要考虑因素。
接受CMV血清阳性的CMV血清阴性成年高危肾移植受者在移植后200天内服用来特莫韦预防CMV感染的效果不劣于缬更昔洛韦,且白细胞减少症或中性粒细胞减少发生风险更低。此外,与缬更昔洛韦相比,接受来特莫韦治疗的受试者没有出现耐药性相关的替代,CMV DNA血症、药物相关不良事件以及因不良事件而中断预防治疗的比例也较低。
首都医科大学临床药学硕士研究生,专业:临床药学。研究方向:结直肠癌相关静脉血栓风险预测模型。
崔向丽,北京友谊医院药剂科副主任,博士,主任药师(执业医师),硕导。研究方向:肝肾移植药学、药物警戒、药物经济学。发表论文180余篇,SCI 27篇。
征稿内容不限于:研究进展、团队科研成果、临床用药经验分享、典型病例解读、疾病诊治经验、人文故事等