Z6尊龙《食品科学》:浙江工业大学关荣发教授等:体外肠道细胞模型及其在评价花青素
Z6尊龙官方网站Z6尊龙官方网站花青素是一种膳食类黄酮,被广泛应用于食品药品中。花青素在胃肠道会被降解,同时受pH值、糖苷键结构、消化酶、肠道微生物群等因素的影响。近年来,细胞培养模型已广泛应用于食品和药学领域的生物利用度和毒理学研究。因此利用模拟体外胃肠道消化和肠道细胞模型能够较好地模拟对花青素的吸收利用。
浙江工业大学食品科学与工程学院的钟浩、徐洁、关荣发*等对二维和三维肠道细胞培养模型的研究进展进行了综述,并探讨了其在花青素吸收转运相关研究中的应用。

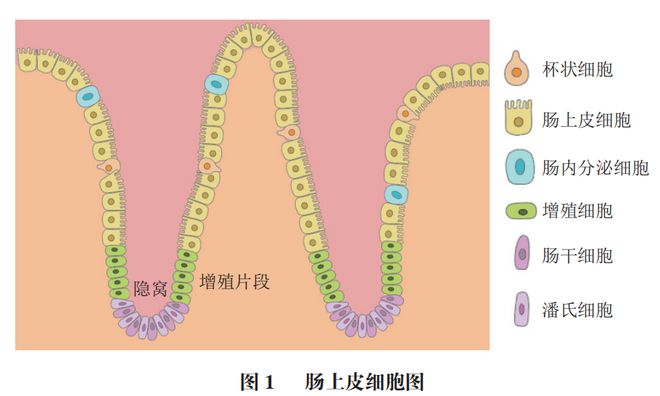
肠道微环境主要由肠道微生物群与其生活的微环境构成,其中包括肠上皮细胞与覆盖上皮细胞的若干黏膜屏障,如含有抗菌分子的黏液层。肠上皮主要由杯状细胞、肠上皮细胞、肠内分泌细胞、增殖细胞、肠干细胞和潘氏细胞等组成(图1)。肠内分泌细胞可以释放肽激素,这与组织修复、血管生成、肠细胞分化和极化有关。杯状细胞可产生黏液,作为抵御有害物质或微生物感染的保护层。同样地,位于隐窝基部的肠干细胞也可以分化为其他肠细胞,从而维持肠道的完整性。肠上皮细胞可以产生黏膜屏障,以隔离肠道微生物群及肠道免疫细胞,维持肠道稳态。黏膜屏障主要包括化学屏障和物理屏障。化学屏障由AMP和Reg3系列蛋白组成,这些蛋白受到肠道内部环境和免疫细胞细胞因子调节;物理屏障则主要包括覆盖肠黏膜的黏液层、肠吸收细胞微绒毛上的糖萼和肠上皮细胞的细胞间连接。
肠道是一个复杂的系统,存在着许多细胞间相互作用和微生物群,肠道细胞模型应尽可能考虑这些因素。常见的体外肠道模型包括二维细胞培养与三维模型。二维培养是指在平面或Transwell小室培养单细胞或多细胞的细胞模型(图2,表1、2),常用的细胞系有Caco-2细胞、HT29细胞、T84细胞、IEC细胞等(表3)。常见的二维共培养是以Caco-2细胞为基础,并结合其他细胞系共培养以向细胞模型添加特定功能,如黏液分泌和免疫反应。三维培养的细胞在细胞外基质(ECM)中或特定的器材中培养,它的目的是提供一种细胞微环境,从而使模型更加接近组织的生理和动态特性。
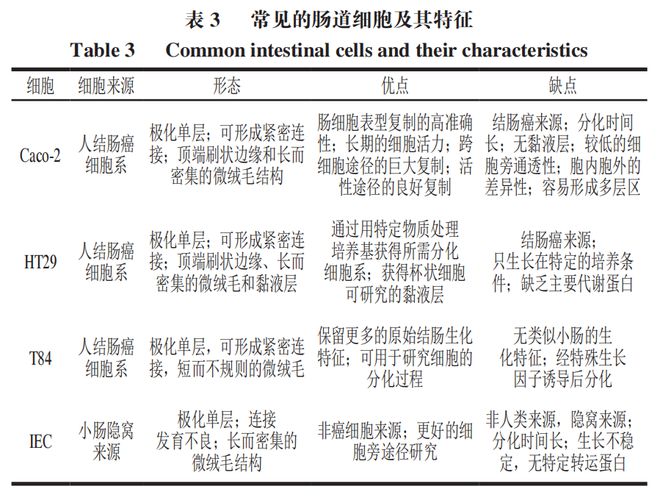
Caco-2细胞系是Fogh等首次从人结肠腺癌中分离出来的细胞系,最初被运用于药物的筛选及耐药机制的研究,是目前应用最为广泛的体外药物分子肠道吸收细胞模型,其结构简单、适应性强、同源性和重现性较好。Caco-2细胞在长达21 d的培养过程中能够自发分化,因此尽管Caco-2细胞起于结肠,但它分化后表现出成熟肠上皮细胞的形态学和功能学特征,具体表现为细胞单层的多种转运体、受体和代谢酶,如细胞色素P4501A、谷胱甘肽S-转移酶等。Shirai等利用不同的转运鉴定琼脂寡糖穿过Caco-2细胞单层的肠道转运机制,结果表明琼脂寡糖能以较为完整的形式以细胞旁途径透过肠上皮。Caco-2细胞也被证明能够通过产生炎症标志物(如细胞因子)响应其他细胞因子(如白细胞介素-1β、肿瘤坏死因子-α和外源性刺激的反应(如脂多糖)。然而,Caco-2细胞系有一定的局限性,包括形成与培养时间和传代数相关的异质单层,这与培养条件、细胞系本身及传代数是密切相关的。目前,人们通过诱导方法获得不同的Caco-2细胞系以降低其变异性,如Caco-2/TC7、Caco-2/15、Caco-2/AQ细胞等。TC7细胞来自Caco-2系的晚期传代(198),通过保留其形态和功能特征使其分化速度快于亲本系,它所形成的细胞单层也更均匀稳定。
HT29细胞是一种人结肠腺癌细胞,由于其成熟肠细胞的典型特征而越来越受到关注,其形态及黏附能力(可分泌黏液,主要由糖蛋白低聚物和相关单体组成)同肠上皮细胞类似,因此该细胞模型被广泛用于研究生物利用度、肠道吸收机制或细胞毒理学。Anna等在HT29细胞系中探究不同浓度MgO纳米颗粒的细胞毒性和遗传毒性发现,MgO纳米颗粒在HT29细胞中无细胞毒性,不会诱导肠上皮细胞的凋亡。同Caco-2细胞不同,HT29细胞可以分化为杯状细胞,这取决于细胞培养过程中的营养物质和培养条件,特别是葡萄糖,故而该细胞系也可用于研究肠上皮细胞分化的体外模型。在标准培养条件下,这些细胞以非极化、未分化的单层形式生长。然而,改变培养条件或用不同的诱导剂处理会导致细胞分化和极化,主要表现为抗原的重新分配和顶端刷状边界膜的发展。同样地,HT29细胞可以在特定条件下被分化为不同的表型,如HT29-FU、HT29-18N2、HT29-MTX等,其中又以HT29-MTX更为稳定,它是利用高浓度的甲氨蝶呤诱导分化HT29而形成的。同其他表型相比,HT29-MTX可以更好地模拟肠道细胞黏液层,因此它们大部分与Caco-2吸收细胞共培养,利用Caco-2细胞的紧密细胞结构以创建一个更适合的体外肠道模型模拟肠上皮细胞。
T84细胞系是由Murakami等于1980年分离得到的人结肠癌细胞系,在结构上与正常肠道细胞相似,其于渗透支架上培养时会形成微绒毛结构和细胞紧密连接。同Caco-2细胞的自发分化不同,T84细胞只有在特定条件诱导下才可以分化,即在人重组转化生长因子等诱导条件下。目前,T84已被广泛地用于研究细胞转运过程及肠道炎症的相关信号通路。Mehmood等利用胆汁酸诱导的T84细胞研究益生菌对肠道健康的影响,通过流式细胞仪和乳酸脱氢酶活性检测发现,益生菌可以显著抑制细胞凋亡和氧化应激的效应,从而改善肠炎患者的不良性腹泻。Cray等在体外使用T84细胞模型和小鼠空肠评估阿霉素对紧密连接基因表达和蛋白质定位的影响,结果发现,阿霉素通过改变细胞紧密连接基因的表达和其动态松弛,增加了小分子(包括细菌产物)通过上皮细胞的旁细胞转运。
IEC细胞系是由Quaroni等首次从大鼠回肠隐窝细胞分离出来而建立的细胞株,这种细胞系具有隐窝细胞的高度分化特性,能够分化为成熟的肠上皮细胞,形成伪单层,表现为微绒毛、紧密连接和类似于基底膜的无定形物质,很难在体外诱导其分化,但通过小鼠肠道间质的处理可令其分化为吸收细胞、杯状细胞、内分泌细胞和潘氏细胞等。该细胞系主要包括IEC-18、IEC-6、IEC-14细胞,其中IEC-18细胞系是最常见的肠屏障模型,主要用于研究营养素的吸收消化及其渗透性,IEC-6细胞系已被广泛用于研究细胞中的分子和遗传机制。同Caco-2细胞相比,IEC细胞系能更好地揭示细胞旁途径的转运机制,特别是Caco-2细胞无法预测的亲水性化合物,但是IEC细胞系具有极大的不稳定性,因为其缺乏许多载体与酶类,如细胞间紧密连接发育不良和轻微极化,并呈现出刷状边界酶的低表达。
通过建立不同类型细胞的共培养模型,使研究细胞-细胞相互作用和研究这些相互作用对生长、分化和免疫反应的影响成为可能。目前,大多数涉及肠道细胞和免疫细胞的共培养模型主要是利用标准的Transwell小室,其中肠道细胞(接种于AP侧)与免疫细胞(接种于BL侧)并不直接接触,而是使用倒置模型被接种在同一个隔间中,因此多用于研究免疫细胞向肠细胞的迁移。然而,共培养模型仍存在局限性,如缺乏细胞-细胞的相互作用、细胞-基质的相互作用,但其仍然是研究肠道炎症、食品成分与肠道相互作用的有效工具。目前应用较多的主要是Caco-2细胞/HT29细胞和Caco-2细胞/靶细胞(肝细胞和免疫细胞)两大类。
在Caco-2细胞和HT29细胞共培养的细胞模型中,由于黏液在药物转运中的作用,使得实验结果可预测性更高。同Caco-2细胞单层相比,Caco-2细胞与HT-29细胞共培养显示出具有紧密连接的刷状边界膜与不规则微绒毛,此外,被动扩散化合物的渗透性更加接近于机体;相反,共培养模型P-糖蛋白(P-gp)的表达水平较低,并且P-gps的数量与HT29细胞的比例呈反比关系。为了探究三甲基壳聚糖衍生物纳米颗粒在体外和体内肠道吸收的特性和机制,Zhao Ying等在Caco-2细胞和Caco-2细胞/HT29细胞共培养细胞模型中研究了该纳米颗粒包封三七皂苷的摄取和转运,发现其可以通过降低紧密连接增强药物的细胞旁途径转运,并利用肠上皮细胞的渗透性增加药物的肠道黏附。也有研究报道Raji B细胞可以在Caco-2细胞中诱导M细胞表型(较少的微绒毛结构和跨细胞活性的较大提升),因而Antunes等开发了一种三重共培养模型,即将Caco-2细胞和HT29细胞共培养后接种至Transwell的AP侧,Raji B细胞接种至BL侧建立正向模型,同时建立反向模型,即将Transwell小室倒置,然后将Caco-2细胞与HT29细胞接种至渗透膜上,再将Raji B细胞接种至AP侧进行共培养。结果表明三重共培养可用于获得更多与生理相关的肠道体外模型,以更好地评价和预测肠道吸收机制。
除了同HT29细胞共培养形成肠屏障模型外(黏液分泌、紧密连接蛋白、刷状边缘),Caco-2细胞也可以同其他细胞共培养用以研究食品功能成分的吸收表达,如肝细胞、免疫细胞等。这种共培养模型通常利用Transwell小室,将Caco-2细胞接种于Transwell小室AP侧,靶细胞接种于BL侧进行培养,从而达到间隔培养的效果。肠道免疫细胞是肠道细胞中数量第二多的细胞类型,也是最常见的共培养细胞之一,用于与肠道细胞系建立共培养模型的主要免疫细胞包括人外周血单个核细胞(PBMC)、人巨噬细胞系(THP-1)或小鼠来源的巨噬细胞系(RAW 264.7)等。已有许多研究利用Caco-2细胞与免疫细胞共培养研究食品天然产物的抗炎活性,但吸收转运相关研究相对较少。由Caco-2细胞和RAW 264.7细胞构成的共培养模型曾被用于验证糖原的免疫调节活性和樟树籽仁乙醇提取物的肠道抗炎活性。Zhang Hua等利用Caco-2细胞单层和Caco-2、THP-1细胞共培养细胞模型探究花青素的生物利用度及抗炎作用。也有实验利用Caco-2细胞与EA.hy926融合细胞共培养以研究部分植物提取物的抗炎活性。
近年来,三维细胞模型的建立技术日趋成熟,它可以更真实地模拟天然组织的生理活性,通常应用于制药领域,主要是药物筛选的相关研究。随着生物工程技术的进步,三维细胞模型可以使用不同的平台进行设计,如三维支架、类器官、微流体模型等。最近,Richter等曾使用Caco-2细胞和2D、3D鼠类器官研究英夫利昔单抗和与泼尼松龙对肠上皮屏障的影响。将细胞进行三维共培养能够更好地模拟原生环境,从而使得药物的渗透性更加接近于机体。
利用传统的细胞单层模型和细胞共培养模型体肠道仍然是一个挑战,而三维支架作为细胞增殖、分化和迁移的支持物能更好地作用于细胞。三维支架是以部分生物材料与细胞一起构建基底细胞层,用于模拟组织的结构。这些生物材料要能够确保营养成分的充分扩散,允许细胞黏附,通常包括一些合成材料(聚二甲基硅氧烷)和细胞外材料(基质胶),其中聚二甲基硅氧烷和水凝胶应用最为广泛。
三维结构的细胞模型非常接近天然肠上皮,这增加了实验模型预测通过被动扩散和主动运输摄入药物的可能性,这无关所使用的支架材料是何种类型。有研究表明,同二维Caco-2细胞模型相比,三维Caco-2细胞模型药物渗透系数更高,药物细胞旁途径也显示出更高的渗透率,这表明三维细胞结构有着与更为类似的肠道屏障功能,这可以增强对肠道动力学预测的准确性。有报道表明,通过比较在水凝胶上培养的Caco-2细胞与2D单层培养的Caco-2细胞的吸收和代谢特性发现,3D模型中的细胞表现出更为类似机体的蛋白表达,代谢酶和碱性磷酸酶的比活性也得到了改善,证明了该3D模型更适用于药物的吸收转运研究。部分三维支架使用纯化的胶原蛋白为基础,从而可以嵌入不同的细胞系,如免疫细胞等,这可以加强细胞间的相互作用。这些模型还探索成功支持Caco-2细胞和HT29-MTX细胞与显著的基质细胞(即成纤维细胞和免疫活性巨噬细胞)共培养的能力。这一设置显示了一个三维更大的吸收表面积,降低了跨膜电阻(TEER)值并促进黏性黏液层的形成。为了评估药物吸收,Li Na等用Caco-2细胞和HT29-MTX细胞接种在胶原基质上构建三维支架,并将THP-1细胞接种到Transwell小室BL侧,其渗透性更低,但低吸收率药物的摄取量也随之增加。总之,这些结果表明基于三维支架的细胞模型有更加类似于肠道的天然特征和功能,也可以根据不同的实验需求组合不同的细胞系,这在药物筛选方面具有很大潜力。
虽然细胞支架在许多结构和功能方面复制了原始组织,但它们具有一些局限性,如三维组织结构不完整、多细胞复杂性较低以及缺乏天然组织所显示的物理力。肠道类器官是指能够在体外生长的微型肠道模型,其可以重现天然肠道组织中的特征,即由微绒毛结构与隐窝组成的高度折叠的上皮结构。类器官来源于从胚胎或成熟隐窝中分离出来的肠道干细胞(ISC)的增殖。在特定的细胞培养条件下,ISC增殖并形成球状(100~700 µm),促进其分化为肠上皮、间充质和管腔样结构,由于其来源稀少,且管腔形态封闭,导致成本高、操作难,目前用于食物成分吸收和利用的研究为数不多,主要用于研究肠道微生物群与临床医学等。Lee等从小鼠小肠中分离出来ISC嵌入基质胶中加入生长因子进行培养,观察到ISC特定标志物的表达和类器官的连续生长。
此外,由于类器官的形状随培养时间和环境的变化而变化,因此很难维持稳定状态,特定的结构也限制了其用于研究许多关键肠道功能(如肠屏障模型的吸收转运)。但目前已有研究提出了解决方法,如显微注射技术用于检测食品成分的吸收转运,或通过机械作用破环其三维结构。
三维流体动力学体外模型是很有前景的工具,其克服了影响静态培养的限制,对肠道复杂的生理学重现性较好,再现了类似体内的动态微环境,同时具有较高的模拟速率和均一性,但由于其体积的限制和模型标准不同其数据仍无法共享。微流体模型被定义为微型细胞培养平台,旨在模拟组织/器官。这项先进技术通过按需控制生物物理和生化因素,概括了复杂的宿主微环境的许多特征,从而实现关键生物过程和疾病状态的重现。为了探究纳米药物对胃肠黏膜的黏附和渗透性,Elberskirch等开发了一种基于HT29-MTX-E12细胞的新型方法产生具有微绒毛和表面黏液层的肿瘤球状体,其将3D肿瘤球体与微流控芯片系统相结合以模拟肠道内的动态环境。
生物芯片是一种微流体装置,其目的是在有限的区域内尽可能地使模型接近目标模拟组织。Volpe等在微流控装置中集成了一个模拟人类肠绒毛的胶原蛋白支架培养Caco-2细胞,这促进了肠上皮屏障的形成及细胞色素P4503A4活性的高表达。器官芯片技术也已被用于开发人类结肠的体外模型。Tsamandouras等通过在由原代肝细胞和Kupffer细胞组成的肝脏微阵列上共培养分化的Caco-2细胞和HT29-MTX细胞单层,建立了一个肠-肝微流控模型系统。
随着生物技术的不断发展,细胞的培养模式已经从传统的单一培养和Transwell小室上的二维共培养转变到细胞外基质支持的三维共培养。三维支架的静态培养和微流体结构的动态培养模型已被广泛应用于研究功能食品成分的吸收转运、抗氧化、抗炎及其免疫调节的影响。Darling等构建成纤维细胞和Caco-2细胞的三维共培养细胞模型,发现成纤维细胞可以产生细胞外源性基质为Caco-2细胞提供上皮支持,使得侧膜及TEER值更接近于肠道以更好地研究药物的渗透性。
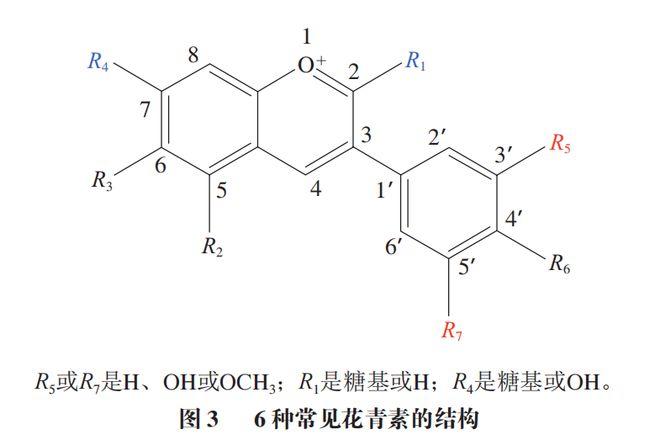
花青素是一类广泛存在于彩色植物中的蓝红色水溶性黄酮类化合物,是一种天然色素,自然状态下的花青素以糖苷形式存在,称为花色苷。自然条件下花青素很少游离存在,而是常与糖类通过糖苷键形成花色苷。花青素分子中有高度分子共轭体系,含酸性与碱性基团,花青素易溶于水、乙醇、甲醇、稀碱与稀酸等极性溶剂。花青素具有抗氧化、抗衰老、保护视力等生理功能,还可以缓解心脑血管疾病、糖尿病、神经退行性疾病、胃肠道疾病等。随着pH值的变化,花青素的颜色会从红色变为不同的颜色,如紫色、橙色、无色和蓝色。自然界已知的花青素有20多种,以天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素最为常见(图3),其中矢车菊色素是自然界中分布最广泛的花青素。花青素的稳定性取决于其结构中b环、羟基或甲氧基的存在,它被认为是有用的功能性食品成分,并被广泛应用于食品工业,自然界中常见的花青素结构如表4所示。然而,花青素在机体的生物利用度较低。绝大多数实验表明,以花青素作为膳食补充剂,在机体中仅有很少的代谢产物在血浆和尿液中以微量水平被检测到。

肠道是花青素主要的吸收代谢部位,其生物利用度受到许多因素的影响,如花青素的化学结构、花青素与食物基质的相互作用、其他膳食化合物的存在以及个体的遗传学和生理学特性。
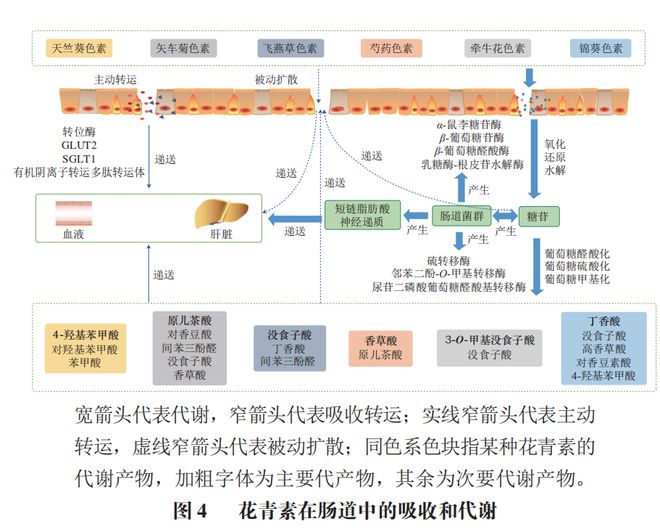
在肠上皮细胞、肝脏和肾脏中,被机体吸收的花青素被单独的代谢酶代谢为葡萄糖醛酸酯、硫酸盐和甲基化代谢产物。肠道微生物参与花青素代谢、维生素合成和碳水化合物分解代谢,同时伴随着酶的作用,如α-L-鼠李糖苷酶、β-D-葡萄糖苷酶和β-D-葡萄糖醛酸酶。花青素在肠道降解主要经过两个阶段的反应,第一阶段包括花青素的氧化、还原和水解。拟杆菌、肠球菌、梭状芽孢杆菌等肠道菌群可以产生多种酶,特别是β-葡萄糖苷酶、α-半乳糖苷酶和α-鼠李糖苷酶等微生物酶类能够使糖苷键裂解和花青素杂环分解并释放花青素苷元。然而这些糖苷元在结肠中不稳定,并被快速降解为酚类化合物等,其中主要包括分别由尿苷二磷酸葡萄糖醛酸基转移酶、硫转移酶和邻苯二酚-O-甲基转移酶催化的葡萄糖醛酸化、硫酸化和甲基化,此即花青素降解的第二阶段。在花青素的降解过程中,通常伴随着肠道微生物群的作用,如拟杆菌属、双歧杆菌属、链球菌属等,天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素、锦葵色素的主要降解产物分别为没食子酸、香草酸、原儿茶酸、4-羟基苯甲酸和丁香酸。花青素降解产生的其他代谢物包括邻苯二酚、邻苯三酚、间苯二酚、酪醇、3-(3′-羟基苯基)丙酸、二氢咖啡酸和3-(4′-羟基苯基)乳酸等。
花青素在内的生物利用度是指其通过血液进入机体的含量,也就是通常所说的花青素在机体内的吸收、代谢、生物转化和排泄,但花青素的生物利用度较低,只有5%~10%的摄入量被机体吸收。普遍认为肠道菌群不仅可以提高膳食酚类物质的生物利用度,也可以增强其抗氧化等生物活性。花青素受益于结肠微生物群的降解,这有助于提高花青素的生物利用度,并可能直接提高其抗氧化活性、抑制血管紧张素转换酶以降低血压水平、促进糖脂代谢、降低血脂水平和抑制炎症反应。
在评估花青素在的生物利用度时,花青素的吸收转运是一个很重要的部分。过去的研究表明花青素在肠道的转运方式主要是被动扩散和主动外排,其中钠依赖性葡萄糖转运蛋白1(SGLT1)和葡萄糖转运蛋白2(GLUT2)是主要的转运载体。Zou Tangbin等利用根皮苷(SGLT1的)、根皮素(GLUT2的)和Caco-2细胞探究SGLT1和GLUT2在矢车菊素吸收中的作用,结果表明,根皮苷和根皮素显著抑制了矢车菊素的吸收,这说明SGLT1和GLUT2可能是矢车菊素生物利用度的限制步骤。此外,通过纳米载体对花青素进行包封,可以提高其生物利用度和吸收转运率。Xu Xiankang等通过制备递送二十二碳六烯酸和花青素的新型脂质体,并结合Caco-2细胞模型与体外消化法评估了这些脂质体的消化和吸收情况,发现磷脂和胆盐的存在使花青素和二十二碳六烯酸相互作用形成胶束。因此,它们的转运途径从依赖转运蛋白的被动扩散转变为网格蛋白介导的内吞作用,这说明经脂质体包封显著改善了花青素的渗透性和吸收率。
目前已应用于花青素肠道吸收研究的体外细胞模型主要包括Caco-2单层细胞模型和Caco-2/靶细胞共培养模型两种,见表5。
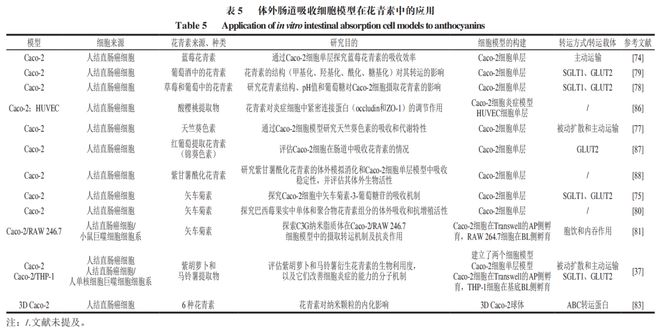
Caco-2单层细胞模型是研究花青素吸收最常用的细胞模型。Cahyana等通过Caco-2细胞模型探究影响花青素在细胞内摄取的因素,结果发现花青素的摄取呈浓度依赖性,并受其结构、环境pH值及葡萄糖的影响,而且随着pH值的降低,花青素的摄取率反而升高,其中有葡萄糖转运蛋白的参与。此外,由于花青素存在不稳定性,其在加工储存中发生的氧化、聚合等反应可能会对花青素在细胞中的吸收转运存在一定的影响。通过Caco-2单层细胞模型运输不同结构的花青素的吸收转运,Liu Yang等发现单一的糖苷标准品的摄取率高于多种混合糖苷标准品,同时花青素的摄取呈现时间依赖性和浓度依赖性,而且SGLT1和GLUT2在其中起着关键作用且SGLT1的影响更显著。
基于Caco-2细胞的共培养模型能更为准确地重建肠道结构和微环境,已被应用于研究花青素等功能活性物质的吸收利用。Yang Mengyu等通过构建Caco-2细胞和RAW246.7细胞共培养炎症细胞模型探究矢车菊素-3-葡萄糖苷(C3G)及C3G纳米脂质体的吸收转运及抗炎机制,发现C3G和C3G纳米脂质体的摄取主要是基于载体蛋白(网格蛋白)介导的巨胞饮作用和内吞作用,而且通过脂质体包埋C3G可以提高其在细胞中的摄取率,这说明脂质体可以在一定程度提高C3G的生物利用度。
目前肠道三维细胞模型在花青素上的应用较少,特别是有关花青素吸收转运的研究。有个别研究利用其他三维细胞模型探究花青素的生物活性。Osvaldt等评估了花青素纳米粒子在2D和3D成纤维细胞中的吸收活性和吸收状况,结果表明两种细胞模型均显示花青素的吸收与时间呈正相关,此外纳米药物也降低了三维细胞中花青素的细胞毒性,这说明药物的纳米化是提高其稳定性的一个有益选择。Hu Die等分别利用二维和三维的Colon26细胞和HepG2细胞研究槲皮素纳米药物的转染效率和细胞毒性,结果发现槲皮素在三维细胞中显示出最高的转染效率,其细胞活性增加。
肠道细胞模型在评估食品功能活性成分的吸收转运中发挥着重要的作用。 尽管体外模型已日趋成熟,但模拟复杂的肠道微生态仍存在着许多局限。 从简单的细胞单层模型到细胞共培养模型再到三维模型,这都说明在体外的肠道模型作为一种体肠道的工具极为重要。 同二维细胞模型相比,三维模型能更为准确地表达细胞形态与细胞生物学功能之间的关系,同时对内源性和外源性刺激(如温度、pH值、营养吸收、迁移、分化等变化)的反应更接近于体内反应。 此外,肠道菌群也参与食品功能活性成分的吸收转运,因此构建肠道菌群与肠道上皮相互作用的功能性肠道模型亦是研究功能活性成分吸收转运的新趋势。
作为一种膳食类黄酮,花青素在维持机体功能和疾病预防等方面都起着重要的作用。然而,目前应用于研究花青素吸收转运的体外肠道模型较少,主要是Caco-2单层细胞模型,但以Caco-2细胞单层研究肠道和功能活性成分或药物之间的相互作用,这存在着一定的局限性。体外肠道细胞模型应更加接近于肠道结构及肠道微生态环境,这将对研究功能活性成分的吸收转运及其机制更有参考意义。

浙江省151人才,浙江省食品学会青年委员会副主任委员,浙江省食品学会常务理事,浙江省农学会常务理事。以第一或主要参与者获得过浙江省科学技术奖一等奖二项、中国商业联合会科技进步特等奖、中国商业联合会科技进步一等奖、中国商业联合会科技进步二等奖、中国轻工业联合会科学技术奖二等奖、浙江省高校优秀科研成果奖二等奖、第十二届全国多媒体课件大赛一等奖、浙江省自然科学优秀论文二等奖、浙江省高校教师软件评比三等奖等奖。作为主持人或主要参加者获国家自然科学基金面上项目、国家“十三五”重点项目子课题、国家质检总局公益科技项目、国家高技术研究发展计划(863计划)项目课题、浙江省重点研发项目、浙江省自然科学基金,浙江省级公益性技术应用研究计划项目,浙江省科分析测试科技计划项目和浙江省质量技术监督系统科研计划项目等项目。主编教材6部,发表SCI等高级别论文100多篇,获国家发明专利12 件,国际发明专利9 件。

主要从事益生菌、微生物发酵及生物活性肽等方面的教学和科研工作。2012年6月获海南大学食品质量与安全专业学士学位,2016年6月获江苏大学粮食、油脂及植物蛋白工程专业硕士学位,2021年3月获浙江大学食品科学专业博士学位。作为主持人,承担浙江省“尖兵领雁+X” 研发攻关计划项目、浙江省自然科学基金探索青年项目、中国博士后科学基金面上资助项目、横向课题3 项;以研究骨干参与多项国家级科研项目。以通信作者或第一作者身份发表SCI论文20余篇,中文EI论文3 篇。授权国家发明专利5 项。 获省级科技成果1 项。
本文《体外肠道细胞模型及其在评价花青素吸收转运中的研究进展》来源于《食品科学》2024年45卷5期303-313.页. 作者:钟浩,徐洁,陈玲,刘晓凤,关荣发. DOI:10.7506/spkx0823-176. 点击下方阅读原文即可查看文章相关信息。


为了帮助食品及生物学科科技人员掌握英文科技论文的撰写技巧、提高SCI期刊收录的命中率,综合提升我国食品及生物学科科技人员的高质量科技论文写作能力。《食品科学》编辑部拟定于2024年8月1—2日在武汉举办“第11届食品与生物学科高水平SCI论文撰写与投稿技巧研修班”,为期两天。
为提高我国食品营养与安全科技自主创新和食品科技产业支撑能力,推动食品产业升级,助力‘健康中国’战略,北京食品科学研究院、中国食品杂志社、国际谷物科技学会(ICC)将与湖北省食品科学技术学会、华中农业大学、武汉轻工大学、湖北工业大学、中国农业科学院油料作物研究所、中南民族大学、湖北省农业科学院农产品加工与核农技术研究所、湖北民族大学、江汉大学、湖北工程学院、果蔬加工与品质调控湖北省重点实验室、武汉食品化妆品检验所、国家市场监管实验室(食用油质量与安全)、环境食品学教育部重点实验室共同举办“第五届食品科学与人类健康国际研讨会”。会议时间:2024年8月3—4日,会议地点:中国 湖北 武汉。