z6尊龙凯时移植药学前沿文摘丨第10期:肝细胞癌的免疫疗法和移植疗法
Z6尊龙官方网站“移植药师主题(SOTP,Solid Organ Transplantation Pharmacy)月评”是由《药学瞭望》编辑部联合首都医科大学附属北京友谊医院药剂科崔向丽主任药师共同发起的移植药师相关学术月评专栏,每月以移植用药为主题展开,旨在介绍国内外移植药物治疗热点,帮助药师快速了解有关领域的进展,提高移植药学服务水平。我们期望本专栏能为医药领域的专家和研究人员提供深入了解相关热点的平台,并为寻求实用知识的一线移植药师提供有益的参考和指导。
2024年1月Journal of Hepatology发表了来自美国西奈山伊坎医学院的雷卡纳蒂-米勒移植研究所的Parissa Tabrizian等学者完成的一篇综述报道,深入探讨了肝细胞癌的免疫疗法和移植疗法,揭示了管理癌症移植候选者和受者的移植肿瘤学家和外科医生所面临的挑战,并对需要进行前瞻性的研究和生物标志物进行探讨,以确定哪些患者可能从移植的免疫疗法中获益。

免疫检查点(ICIs)已成为晚期肝细胞癌(HCC)的主要治疗手段z6尊龙凯时,并在切除术前的新辅助治疗中显示出良好的前景。肝移植(LT)是无法切除的早期肝细胞癌或局部治疗后局部晚期肝细胞癌的首选治疗方法,但肝移植后需要免疫预防排斥反应,这与ICIs的免疫增强作用相冲突。新辅助ICIs可使部分LT候选者获益,但在了解反应指标和管理LT后风险方面仍存在挑战。尽管肝脏特异性因素可降低排斥风险,但LT术后严重排斥反应的报道引起了人们的关注,促使探索LT术前使用ICIs的可能性。PD-1/PD-L1一直是关注的焦点,但LT前最佳ICIs方案仍不确定,临床研究必须强调严格的患者选择和管理。移植的优势在于可以在预先确定的洗脱期暂停ICIs。在LT术后,一般避免使用ICIs,但有一些报告表明,移植肝中PD-L1的表达可能是一种安全的生物标志物,尽管存在风险,但对于无法切除的HCC复发的患者来说,ICIs免疫治疗比支持性治疗效果更好。这项专家意见凸显了HCC与LT管理的复杂性。未来需要通过多中心前瞻性临床研究和生物标志物来明确肝移植术前或术后安全有效的免疫治疗方案。
目前,基于ICIs的免疫疗法已成为HCC患者的一线治疗方案,最近公布的临床研究IMBRAVE 050结果显示,在肝癌切除术后使用新辅助治疗组,无复发的生存率有所改善。一些小型临床研究表明,在切除术前使用ICIs新辅助治疗是安全的,并且比在晚期使用有更好的应答率。目前正在进行一些临床研究,以评估在肝内无法切除的HCC患者中使用ICIs替代或补充局部治疗(LRT)的潜力。LT是无法切除的早期HCC患者的首选治疗方法,也是局部晚期HCC的首选治疗方法,这些患者的肿瘤大小、数量和甲胎蛋白(AFP)可通过LRT降至可接受范围内。LT术后需要长期使用免疫预防排斥反应;ICIs增强而非抑制免疫反应。有研究显示,接受移植治疗的癌症患者在移植术后出现不可逆排斥反应的比例很高。因此,前期研究一致认为应避免在移植术后使用ICIs。然而,在移植前使用ICIs是一个备受关注和争论的领域,本文将对此进行讨论(图1)。
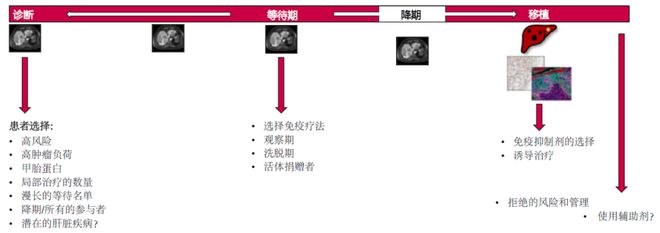
HCC复发最常累及肝脏,可能是肝内转移或新发HCC的结果。而LT后的复发通常是肝外转移的结果。肿瘤大小、数量和AFP的标准是选择移植候选者的基础,也是肝外转移的替代标志物。对于符合米兰标准的HCC患者,如果对LRT有反应,并接受了有效的移植,那么LT后复发的可能性很低。因此没有必要考虑新辅助免疫疗法。然而,如果符合米兰标准的HCC患者对长程放化疗无效,或由于等待时间过长而需要反复进行长程放化疗,但疗效却越来越差,或者不符合长程放化疗条件,那么ICIs就会成为一种有吸引力的治疗选择。局限于肝脏的HCC患者,其肿瘤最初超出了米兰标准,可通过降期治疗达到米兰标准,符合优先移植的条件,但退出移植和LRT后复发的风险会增加。此外,并非所有尝试降期治疗都能实现降期。这种情况下,ICIs是一种很有前景的方法z6尊龙凯时,既能提高进入LT的患者比例,又能减少LT后复发(图2)。
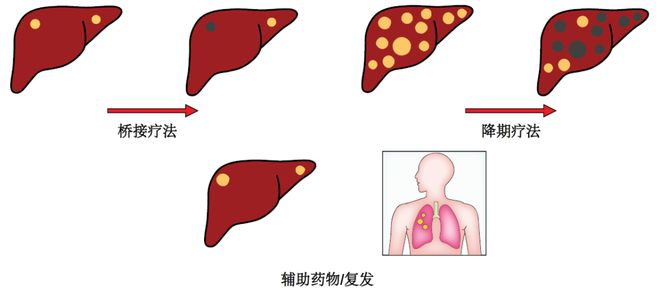
ICIs治疗后完全影像学缓解后的LT适应症尚未明确。有研究表明,完全病理缓解与LT后无复发和总生存率的提高有关。然而,LT前的影像学检查与病理反应的相关性尚不明确;LRT后的分期不足仍是一个难题,病理解剖仍显示未识别肿瘤的比例很高,往往超过米兰标准。纳入免疫疗法进一步增加了反应评估的复杂性,到目前为止,还没有任何研究将ICIs治疗HCC后的影像学变化与病理学相关联。与无应答患者相比,对ICIs完全或部分应答的患者可获得更好的肿瘤治疗效果。虽然ICIs完全或部分应答患者的肿瘤治疗效果优于无应答患者,且应答持续时间也长于细胞毒性化疗,但治愈率似乎较低。此外,导致HCC的潜在疾病仍然存在。近期研究显示,在因结直肠癌肝转移而接受LT治疗的患者中,影像学检查与LT术后病理学检查并不完全相关,在影像学检查中转移灶消失的部位通常会发现存活的肿瘤。在开发根据影像学或其他生物标志物能够可靠地预测完全病理反应的工具之前,对于那些最初被认为是最佳治疗方法的患者,尽管有明显的完全病理反应,但仍应谨慎地继续进行LT治疗。
一些报道称,在移植前接受ICIs治疗的患者在LT后出现了快速致命的排斥反应。导致许多中心完全避免在等待LT的患者中使用ICIs。然而,肝脏和LT的许多独特因素可能会降低这种风险。肝脏是一个大器官,其内皮表面积远远大于其他可移植器官。肝脏具有出色的再生能力,能够从损伤中恢复。与肾脏和心脏相比,MHC II类抗原在肝脏中的表达较弱。肝脏免疫系统受细胞特异性机制的高度调节,具有进化基础,以避免对门静脉血液中与无害肠道菌群相关的抗原产生不适当的反应。尽管移植过程可能会有所不同,但移植过程中通常会有大量失血,循环中的ICIs也会受到一定程度的洗脱。也许最重要的是,肝脏再灌注后会开始大规模免疫抑制,从而关闭T细胞反应。对于那些只有接受肝移植才能存活的患者的治疗需求,以及考虑到上述缓解因素,一些中心已经开始探索在LT前使用ICIs,主要针对超米兰标准的HCC患者。
迄今为止,几乎所有在LT前期使用ICIs的经验都是针对程序性死亡受体1(PD-1)与程序性死亡配体1(PD-L1)之间的相互作用。虽然抗PD-1和抗PDL-1抗体几乎可以互换使用,但有证据表明,使用抗PD-L1比使用抗PD-1药物更容易出现同种排斥反应。因为PD-L1除了是PD-1的配体外,还是B7-1(CD80)检查点的配体(图3)。联合疗法可提高应答率,是晚期HCC治疗的标准疗法。对于肿瘤超过米兰标准的HCC患者,如果要达到LT标准,必须要有应答,适合采用联合疗法。对于符合米兰标准的患者,如果目的是维持移植标准,最好先使用联合疗法进行诱导治疗,然后再使用单药进行维持治疗,这样既能避免不良反应,又能达到LT标准。抗血管内皮生长因子(VEGF)抗体会影响伤口愈合,对于有可能在6周内进行移植的患者,术前最好不要使用。
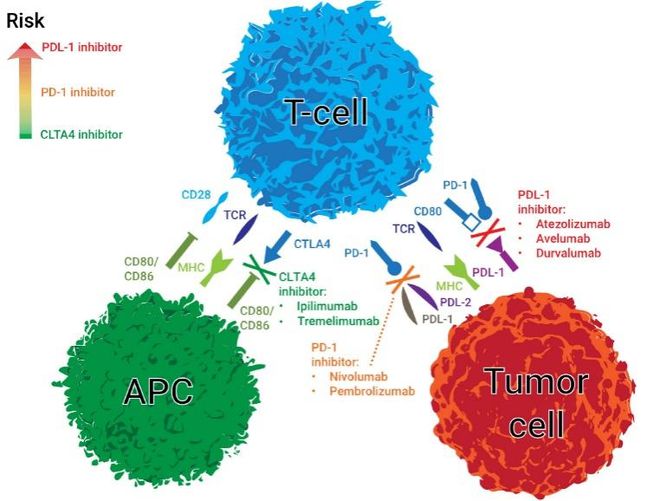
(APC,抗原呈递细胞;CTLA-4,细胞毒性t淋巴细胞抗原4;LT,肝移植;PD-1,程序性死亡受体1;PD-L1,程序性死亡配体1;TCR,T细胞受体。)
ICIs是一种单克隆抗体,用药后可在体内长期存在。以3 mg/kg的剂量对晚期癌症患者进行的纳武利尤单抗药代动力学研究显示,ICIs与靶点的结合亲和力很强,其平均血清半衰期为13天。晚期患者PD-1上的纳武利尤单抗占位率在最后一次给药后3个月左右才开始下降。尽管由于失血和复苏,可能导致血清水平急剧下降,但目前尚无肝移植围术期的药代动力学数据。各种ICIs的药代动力学似乎相似。LT前洗脱期的重要性以及洗脱期的长短尚不清楚。对于等待已故捐献者器官的患者来说,LT的时间并不确定,因此很难规定精确的洗脱期。基于以上列举的各种诱导因素,我们中心一直将单药ICIs治疗持续到LT时,没有证据表明出现严重的早期排斥反应。然而,一些小型回顾性病例分析发现,在LT后3个月内使用ICIs是导致LT后排斥反应的一个危险因素。一项正在进行的多中心前瞻性临床研究(NCT05185505)规定了6周的洗脱期。虽然适当的时间长度仍有待确定,但在LT前进行一段时间的洗脱和观察可能是合适的。
各中心对LT后免疫抑制的管理各不相同。通常,在肝脏再灌注时使用大剂量,广泛抑制免疫再排斥,特别是诱导T细胞凋亡,并抑制T细胞增殖;大剂量是治疗严重ICIs相关免疫反应的方法。钙调磷酸酶是移植免疫抑制的主要药物,它通过抑制T细胞生成白细胞介素-2和其他细胞因子的转录来抑制T细胞的活化、增殖和分化。霉酚酸酯会优先消耗T淋巴细胞和B淋巴细胞中的鸟苷酸核苷酸,从而抑制它们的增殖。目前的趋势是在LT后减少甚至停用类固醇,这通常是有益的;早期类固醇用药强度的变化可能是导致在LT前接受ICIs的患者早期排斥反应发生率变化的部分原因。使用抗胸腺细胞球蛋白等消耗T细胞的药物诱导免疫抑制,会导致T细胞大量消耗。世界各地在LT后使用抗胸腺细胞球蛋白或类似药物的情况各不相同,这似乎是避免ICIs相关排斥反应的有效方法;但淋巴细胞耗竭会诱导存活的淋巴细胞发生同源性增殖并分化为记忆性T细胞,从长远来看有可能损害移植物耐受性的发展。然而,在围移植期使用免疫疗法时,各机构对免疫抑制方案的管理不尽相同。目前还未就最佳治疗方案达成共识,但有研究报道,除外,接受至少一种免疫抑制药物治疗的患者无排斥反应存活率更高。
在肝移植物再灌注之前,受者的免疫系统还没有识别到供体抗原,通过免疫抑制T细胞反应,应该可以防止导致排斥反应的一系列事件。对于已出现的严重排斥反应的个别病例,一种可能的解释是存在针对肝脏移植物中异体抗原的免疫记忆。发生这种情况的潜在机制包括:通过父亲在怀孕前接触了供体的HLA抗原,或输注了与异体移植物中存在相同抗原的供血者的血液,或病原体与移植物中产生的抗原之间产生交叉反应。长期以来,在移植手术中一直采用受者血清与供者淋巴细胞交叉配型的方法来检测预先形成的抗HLA抗体,但这种方法在肾移植中的相关性要大得多,因为肾移植的排斥风险要比LT大得多。不过,也可以使用酶联免疫吸附点测定法进行T细胞交叉配对,以确定受者体内产生干扰素γ-(IFNγELISPOT)的供体反应性T记忆细胞。研究表明,对ICIs有反应的癌症患者通常都有针对肿瘤抗原的记忆T细胞。虽然IFNγcELISPOT临床研究有些繁琐,但如果能证明在LT前接受ICIs的患者的排斥反应与预先存在的T细胞记忆或供体抗原有关,那么在供体环境中进行该临床研究将是可行的。
2022年,在美国,器官移植(LDLT)仅占LT手术的6%,但在其他国家,尤其是亚洲,器官移植占LT手术的大多数。在LT治疗HCC的情况下,LDLT消除了等待供体器官的需要以及随之而来的退出候选名单的风险,也消除了在等待期间为防止肿瘤进展而进行多种治疗的必要性,还允许中心对不符合优先候选名单标准范围内的肿瘤患者进行移植。缺血再灌注损伤(IRI)在某种程度上是所有器官移植的固有现象,IRI的程度与随后发生的炎症和抗原释放与排斥反应的可能性相关;在LDLT中,IRI风险可降至最低。LDLT有利于肝移植术前ICIs的管理,因为择期手术可以控制相对于LT手术日期的给药时间,允许在LT手术前的特定时间内暂停使用ICIs和抗血管内皮生长因子疗法。免疫疗法有可能扩大LT的适应症,将以前被认为HCC复发风险过高而不适合进行LT手术的患者(如大血管侵犯)纳入其中,这将主要在LDLT环境中进行探索,因为这些患者不符合优先候诊的条件;这需要在临床研究中谨慎对待,既要考虑到LDLT中有关供体风险的伦理问题,又要考虑受体合理的预期获益。
尽管执行了严格的肝移植手术标准,LT后的HCC复发率仍高达20%,且大多发生在术后2-3年内。目前还没有证实任何辅助疗法可以预防复发。一些研究和病例报告探讨了使用免疫疗法治疗LT术后HCC复发或新恶性肿瘤的效用。早期的研究显示,LT后使用ICIs会带来毁灭性的风险,包括移植物损失高达50%。确定哪些患者可以在肝移植后安全地接受免疫疗法是临床研究关注的一个领域。根据小型的回顾性数据和前瞻性研究,移植肝脏中的PD-L1表达水平被认为是一种潜在的安全生物标志物,但要在这种情况下使用免疫疗法,还需要更有力的数据支持。最近,Di Marco等人发表了利用免疫疗法治疗LT后晚期HCC复发的结果,证明与单纯支持治疗相比,加用纳武利尤单抗和贝伐珠单抗可提高总生存率。需要开展多中心研究,以制定安全有效的治疗方案。
AFP:甲胎蛋白;HCC:肝细胞癌;ICIs:免疫检查点;IRI:缺血再灌注损伤;LDLT:肝移植;LRT:局部治疗;LT:肝移植;PD-1:程序性死亡受体1;PD-L1:程序性死亡配体1。
崔向丽,北京友谊医院药剂科副主任,博士,主任药师(执业医师),硕导。研究方向:肝肾移植药学、药物警戒、药物经济学。发表论文180余篇,SCI 27篇。
征稿内容不限于:研究进展、团队科研成果、临床用药经验分享、典型病例解读、疾病诊治经验、人文故事等